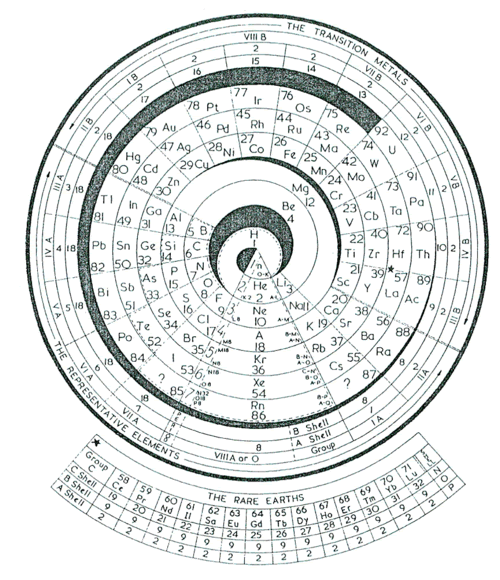
MODELO DE CHARLES JANET
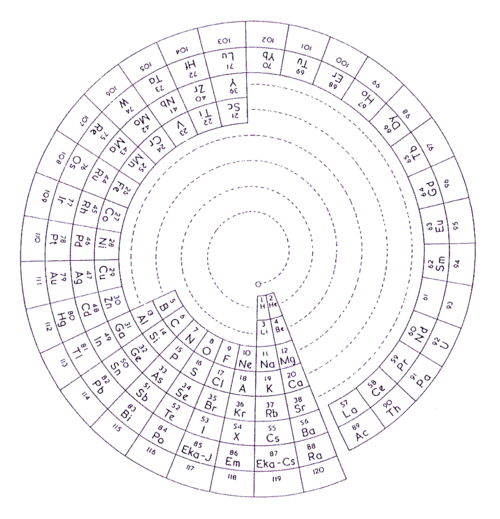
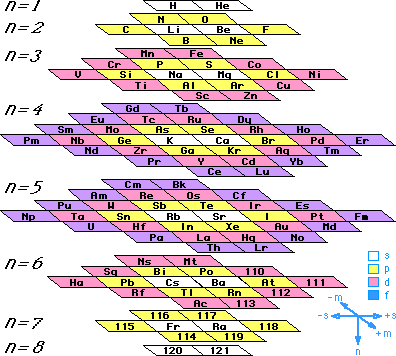
Charles Janet, geólogo y entomólogo, diseñó (1929) una tabla circular con cuatro tipos de períodos. El primer tipo comprende los dos primeros períodos cortos, que integran los cuatro primeros elementos del sistema. El segundo tipo comprende a los elementos representativos de los períodos 3 y 4. El tercero a las dos primeras series de transición (incluidos los elementos representativos) y el cuarto tipo comprende además los lantánidos y actínidos.
También en 1929 Janet publicó un modelo simplificado, de una tabla suya del año anterior, hecha en 3 dimensiones y con forma helicoidal. La tabla simplificada, que llamó escaliforme por su aspecto en forma de escalera, es similar a la de arriba solo que desplegada por los extremos desde el La hasta el He (ver modelo de Janet adaptado por Albert Tarantola).
MODELO DE ROMANOFF
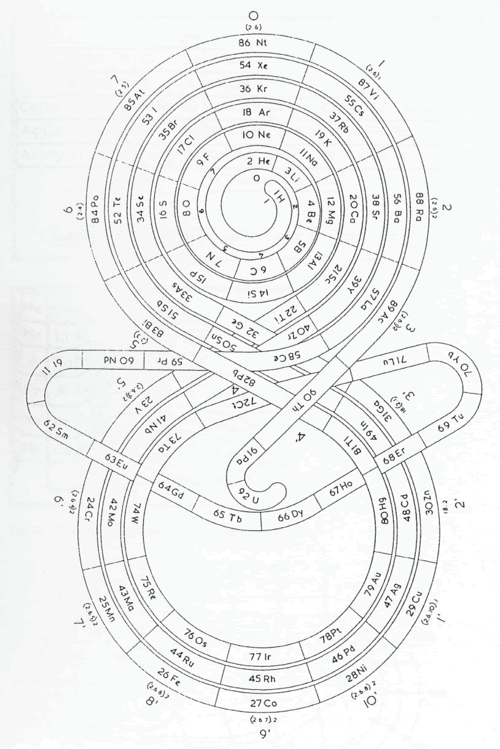
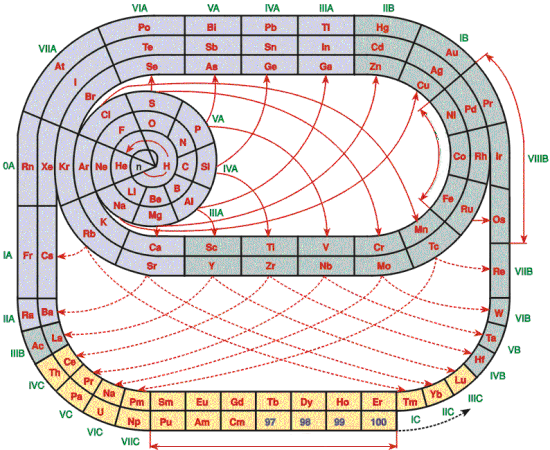
Romanoff presentó en 1934 un sistema con los elementos distribuidos en una curva similar al infinito matemático. En el anillo superior se encuentran los elementos representativos y en el inferior los elementos de transición. Las tierras raras se encuentran en una extensión transversal que enlaza los dos círculos y da continuidad a los elementos con el Celtio (Ct, hoy Hf) hasta el U.
MODELO DE ZMACZYNSKI
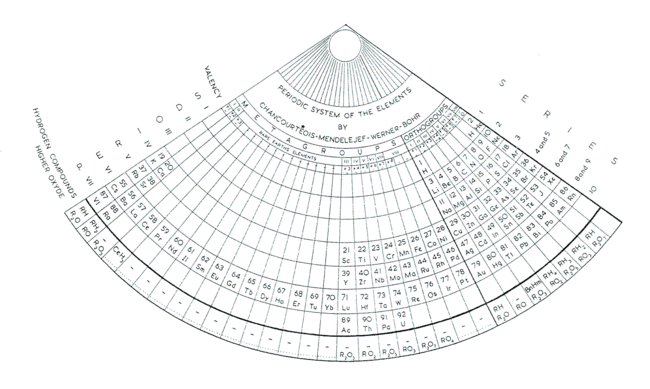
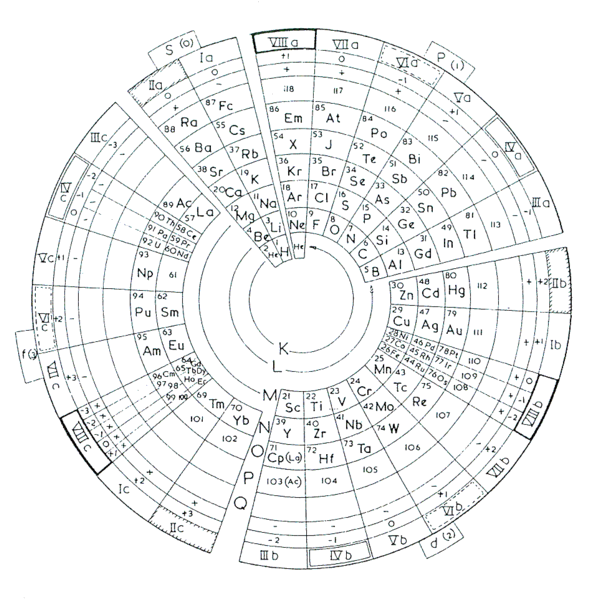
El sistema propuesto por E. Zmaczynski en 1937, bautizado por él mismo como Sistema Periódico de los Elementos por Chancourtois-Mendeleiev-Werner-Bohr, fue utilizado durante años en la Universidad de Minsk. Divide los grupos en metagrupos y ortogrupos, según sean períodos largos o cortos. De este modo el Li y Na pasan a ser análogos del Cu, Ag y Au, lo mismo que ocurre al Be y Mg que lo son del Zn, Cd y Hg. Al igual que Bohr no incluye al Ac, Th, Pa y U entre las tierras raras sino como homólogos de los metales de transición Lu, Hf, Ta y W.
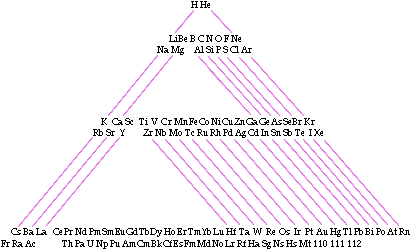
Otra tabla creada por Emil Zmaczyinski recuerda la propuesta por Bohr. Utiliza lineas para unir los grupos. La forma triangular permite introducir los lantánidos y actínidos dentro del cuerpo de la tabla y en el lugar correspondiente.
MODELO DE EDGAR EMERSON
Edgar Emerson hace en 1944 un intento de expresar las diferencia entre los períodos largos y cortos mediante un sistema en espiral. Según este modelo, el Be y Mg podían situarse sobre el Ca y Sr o bien al otro extremo sobre le Zn. Emerson propone una solución de compromiso como de puente entre los subgrupos del Ca y el Zn y como homólogos de los dos grupos.
Además el H aparece como homólogo de los alcalinos y de los halógenos. En la cúspide del grupo de los gases nobles Emerson coloca el neutrón, como elemento cero pues aducía que tenía propiedades de gas noble.
MODELO DE SCHEEELE
Este modelo es uno de los varios que Scheele diseñó en los años 50. Basado en la teoría electrónica coloca los elementos en capas: K, L, M, N, etc. de 2, 8, 18, 32 elementos. Tiene el inconveniente de que no existe continuidad creciente en el número atómico.
MODELO DE CLARK
En 1950 Clark presentó un modelo con una forma similar a la proyección de un estadio sobre su base. Con este diseño, Clark, conseguía que la distancia entre los elementos de un subgrupo y los dos que hacen de representativos del grupo estuvieran en relación directa a la diferencia entre sus propiedades. Así el subgrupo del Cu está más alejado del Li y del Na que el subgrupo del K por ser mayores sus diferencias respecto a los representativos del grupo. Los homólogos en la figura están unido mediante lineas rojas.
MODELO POR ED PERLEY
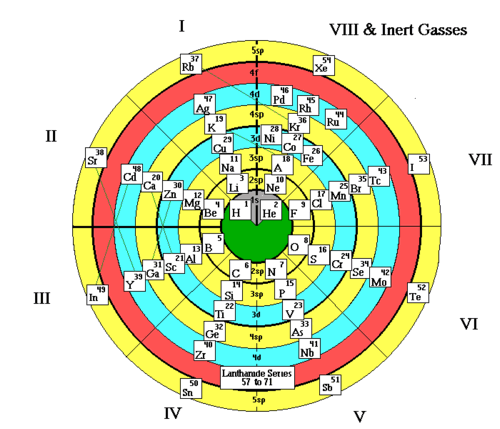
Dado el carácter cíclico del llenado de orbitales de los elementos, Ed Perley diseña una tabla con estructura circular. Partiendo de una tabla de períodos cortos (con los subgrupos A y B juntos), el esquema muestra la estructura habitual de las capas electrónicas excepto que agrupa los orbitales s y p. Así las capas sp son de color amarillo, los orbitales d de color azul y los f de color rojo. Entonces los elementos se colocan en las capas que son responsables de sus propiedades. Esto hace que haya algunos saltos que se representan en el esquema mediante lineas de puntos.
Los metales de transición comienzan en el grupo III y acaban en el II gracias a que el grupo VIII contine las tríadas y los gases nobles. Los lantánidos no se disgregan en la capa correspondiente porque en la tabla tradicional están todos en el mismo grupo. Solo están dibujados los elementos hasta el número 51.
MODELO DE TIMMOTHY
La tabla diseñada por el Dr. Timmothy Stowe presenta los elementos en capas según el número cuántico principal y diferenciando el resto de los números cuánticos según el color.
MODELO DEL PROFESOR THEODOR BENFEY
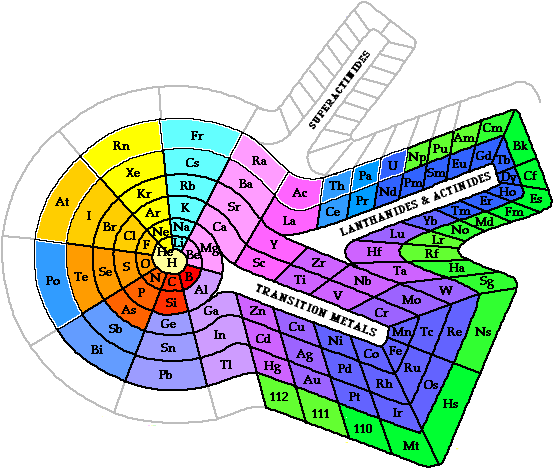
Diseñada por Theodor Benfey en 1964, permite colocar todos elementos, ordenados por número atómico, conservando los periodos, incluyendo lantánidos y actínidos, mostrando que los metales de transición también son algo especial, y además seguirá disponiendo de hueco para cuando, si, se descubren elementos superiores al 120, cuando supuestamente aparecería un nuevo tipo de orbital, superior al f. Esta disposición deja espacio para añadir propiedades a la lista de elementos.
MODELO DE PIERE DEMERS
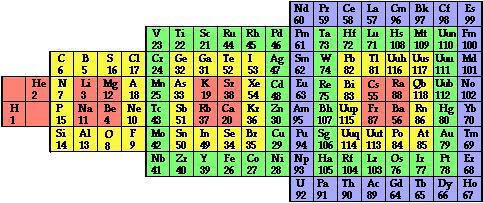
Piere Demers, profesor de la Universidad de Montreal, propuso en 1995 un sistema peródico basado en el elemento 118 al que llamó Quebecium, de la misma manera que existe el Lutecium o Francium. Con el elemento Quebecium queda cerrado el sistema periódico y a partir de él, quitando electrones se obtendrian el resto de los elementos hasta el hidrogeno.
MODELO DE ALBERT TARANTOLA
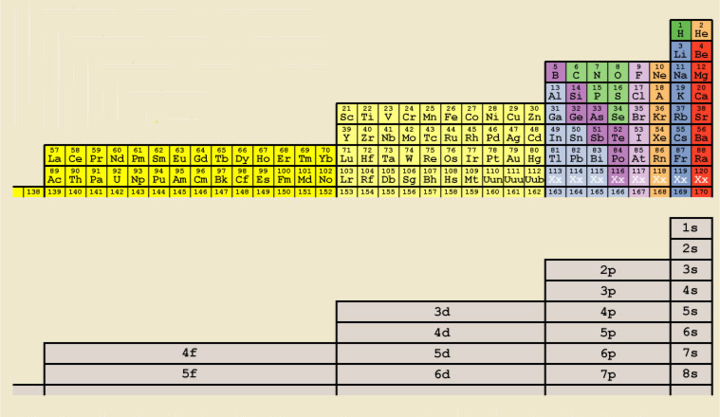
Albert Tarantola, profesor en la Universidad de la Sorbonne, recuperó en 1970 la tabla poco conocida de Charles Janet. Esta tabla, que tiene forma de escalera, sigue el orden de llenado de las capas electrónicas. En esta tabla el He figura junto con los alcalinotérreos por poseer una configuración similar.
La configuración electrónica de un átomo se obtiene de un modo simple a partir del esquema inferior. De manera que el Al por ejemplo, tendría que tener una configuración electrónica de 1s2 2s2 2p6 3s2 3p1
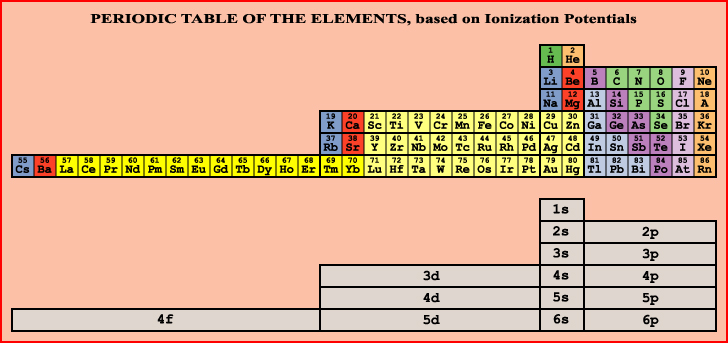
Si el orden de llenado de los orbitales electrónicos da lugar a una clasificación como la de arriba, el orden de "vaciado" de los orbitales electrón por electrón no da la misma clasificación, sino una diferente. Albert Tarantola recopiló las energías de ionización de los elementos y organizo esta otra tabla:
MODELO DE MOELLER

Los elementos se ordenan de abajo a arriba, es decir por períodos que ahora son verticales. Sin embargo no se completan los elementos por número atómico, sino por capas electrónicas y no por su orden energético de llenado sino por orden numérico. De este modo los elementos de transición como el Sc (donde se inicia el llenado de orbitales 3d) y siguientes figuran detrás del Ar (donde se acaban de llenar los orbitales 3p). Es decir se mantiene el orden nominal de los orbitales sin aplicar el diagrama de Moeller.
Charles Janet, geólogo y entomólogo, diseñó (1929) una tabla circular con cuatro tipos de períodos. El primer tipo comprende los dos primeros períodos cortos, que integran los cuatro primeros elementos del sistema. El segundo tipo comprende a los elementos representativos de los períodos 3 y 4. El tercero a las dos primeras series de transición (incluidos los elementos representativos) y el cuarto tipo comprende además los lantánidos y actínidos.

También en 1929 Janet publicó un modelo simplificado, de una tabla suya del año anterior, hecha en 3 dimensiones y con forma helicoidal. La tabla simplificada, que llamó escaliforme por su aspecto en forma de escalera, es similar a la de arriba solo que desplegada por los extremos desde el La hasta el He (ver modelo de Janet adaptado por Albert Tarantola).
MODELO DE ROMANOFF
Romanoff presentó en 1934 un sistema con los elementos distribuidos en una curva similar al infinito matemático. En el anillo superior se encuentran los elementos representativos y en el inferior los elementos de transición. Las tierras raras se encuentran en una extensión transversal que enlaza los dos círculos y da continuidad a los elementos con el Celtio (Ct, hoy Hf) hasta el U.

MODELO DE ZMACZYNSKI
El sistema propuesto por E. Zmaczynski en 1937, bautizado por él mismo como Sistema Periódico de los Elementos por Chancourtois-Mendeleiev-Werner-Bohr, fue utilizado durante años en la Universidad de Minsk. Divide los grupos en metagrupos y ortogrupos, según sean períodos largos o cortos. De este modo el Li y Na pasan a ser análogos del Cu, Ag y Au, lo mismo que ocurre al Be y Mg que lo son del Zn, Cd y Hg. Al igual que Bohr no incluye al Ac, Th, Pa y U entre las tierras raras sino como homólogos de los metales de transición Lu, Hf, Ta y W.

Otra tabla creada por Emil Zmaczyinski recuerda la propuesta por Bohr. Utiliza lineas para unir los grupos. La forma triangular permite introducir los lantánidos y actínidos dentro del cuerpo de la tabla y en el lugar correspondiente.

MODELO DE EDGAR EMERSON
Edgar Emerson hace en 1944 un intento de expresar las diferencia entre los períodos largos y cortos mediante un sistema en espiral. Según este modelo, el Be y Mg podían situarse sobre el Ca y Sr o bien al otro extremo sobre le Zn. Emerson propone una solución de compromiso como de puente entre los subgrupos del Ca y el Zn y como homólogos de los dos grupos.

Además el H aparece como homólogo de los alcalinos y de los halógenos. En la cúspide del grupo de los gases nobles Emerson coloca el neutrón, como elemento cero pues aducía que tenía propiedades de gas noble.
MODELO DE SCHEEELE
Este modelo es uno de los varios que Scheele diseñó en los años 50. Basado en la teoría electrónica coloca los elementos en capas: K, L, M, N, etc. de 2, 8, 18, 32 elementos. Tiene el inconveniente de que no existe continuidad creciente en el número atómico.

MODELO DE CLARK

En 1950 Clark presentó un modelo con una forma similar a la proyección de un estadio sobre su base. Con este diseño, Clark, conseguía que la distancia entre los elementos de un subgrupo y los dos que hacen de representativos del grupo estuvieran en relación directa a la diferencia entre sus propiedades. Así el subgrupo del Cu está más alejado del Li y del Na que el subgrupo del K por ser mayores sus diferencias respecto a los representativos del grupo. Los homólogos en la figura están unido mediante lineas rojas.
MODELO POR ED PERLEY

Dado el carácter cíclico del llenado de orbitales de los elementos, Ed Perley diseña una tabla con estructura circular. Partiendo de una tabla de períodos cortos (con los subgrupos A y B juntos), el esquema muestra la estructura habitual de las capas electrónicas excepto que agrupa los orbitales s y p. Así las capas sp son de color amarillo, los orbitales d de color azul y los f de color rojo. Entonces los elementos se colocan en las capas que son responsables de sus propiedades. Esto hace que haya algunos saltos que se representan en el esquema mediante lineas de puntos.
Los metales de transición comienzan en el grupo III y acaban en el II gracias a que el grupo VIII contine las tríadas y los gases nobles. Los lantánidos no se disgregan en la capa correspondiente porque en la tabla tradicional están todos en el mismo grupo. Solo están dibujados los elementos hasta el número 51.
MODELO DE TIMMOTHY
La tabla diseñada por el Dr. Timmothy Stowe presenta los elementos en capas según el número cuántico principal y diferenciando el resto de los números cuánticos según el color.

MODELO DEL PROFESOR THEODOR BENFEY

Diseñada por Theodor Benfey en 1964, permite colocar todos elementos, ordenados por número atómico, conservando los periodos, incluyendo lantánidos y actínidos, mostrando que los metales de transición también son algo especial, y además seguirá disponiendo de hueco para cuando, si, se descubren elementos superiores al 120, cuando supuestamente aparecería un nuevo tipo de orbital, superior al f. Esta disposición deja espacio para añadir propiedades a la lista de elementos.
MODELO DE PIERE DEMERS

Piere Demers, profesor de la Universidad de Montreal, propuso en 1995 un sistema peródico basado en el elemento 118 al que llamó Quebecium, de la misma manera que existe el Lutecium o Francium. Con el elemento Quebecium queda cerrado el sistema periódico y a partir de él, quitando electrones se obtendrian el resto de los elementos hasta el hidrogeno.
MODELO DE ALBERT TARANTOLA

Albert Tarantola, profesor en la Universidad de la Sorbonne, recuperó en 1970 la tabla poco conocida de Charles Janet. Esta tabla, que tiene forma de escalera, sigue el orden de llenado de las capas electrónicas. En esta tabla el He figura junto con los alcalinotérreos por poseer una configuración similar.
La configuración electrónica de un átomo se obtiene de un modo simple a partir del esquema inferior. De manera que el Al por ejemplo, tendría que tener una configuración electrónica de 1s2 2s2 2p6 3s2 3p1

Si el orden de llenado de los orbitales electrónicos da lugar a una clasificación como la de arriba, el orden de "vaciado" de los orbitales electrón por electrón no da la misma clasificación, sino una diferente. Albert Tarantola recopiló las energías de ionización de los elementos y organizo esta otra tabla:
MODELO DE MOELLER

Los elementos se ordenan de abajo a arriba, es decir por períodos que ahora son verticales. Sin embargo no se completan los elementos por número atómico, sino por capas electrónicas y no por su orden energético de llenado sino por orden numérico. De este modo los elementos de transición como el Sc (donde se inicia el llenado de orbitales 3d) y siguientes figuran detrás del Ar (donde se acaban de llenar los orbitales 3p). Es decir se mantiene el orden nominal de los orbitales sin aplicar el diagrama de Moeller.